根据国际黑暗天空协会 (2022),光污染被定义为“不恰当或过度使用人造光,可能对人类、野生动物和我们的气候造成严重的环境后果”。
光污染的增加正在成为一个全球性问题,它对生态和经济都有影响。夜间人造光对环境的影响是复杂而深远的,其后果延伸到社会、经济和政治领域。
光污染问题可以追溯到工业革命,当时照明技术的进步导致人工照明的广泛使用。如今,紧凑型荧光灯(cfl)和发光二极管(led)等高效照明系统使人工照明比以往任何时候都更节能。然而,这种效率的提高并没有带来相应的光污染的减少。事实上,随着城市的快速发展和人工照明在以前没有照明的地区的普及,情况发生了相反的变化。
2023年1月15日,同济大学环境科学与工程学院和上海市污染控制与生态安全研究所的研究人员在Sciencedirect上发布了名为“Understanding light pollution: Recent advances on its health threats and regulations”的研究报告,对光污染问题进行了介绍。
不想看原报告的朋友可以参考以下报告要点:
•综述了光污染对健康的威胁研究进展(2018-2022)。
•强调夜间人造光和蓝光的影响。
•揭示了光污染与高度关注的健康影响之间的联系。
•突出了破坏昼夜节律的毒理学机制。
•讨论了调节控制光污染应做出的努力。
同时,大家可能会对我们处于的光污染和自然光(如天空晴朗下的月光和星空)的水平对比感兴趣。这些在原报告中都有详细的数据。在此提前透露下,晚上室内室外照明灯、电脑屏幕、手机屏幕的光照水平都是自然月光的几十乃至几百倍。
以下为报告内容,由生活100编译。
背景
人造光的普及不仅改善了现代社会的照明条件,同时也对人类健康构成了种种健康威胁。尽管有关于光污染的法规和标准,但很少有法规和标准是基于不当照明对疾病的潜在影响。因此,更好地了解光污染引起的健康威胁可能会促进风险评估和更好地监管人造光,从而营造健康的照明环境。
本综述基于对 2018 年至 2022 年关于光污染对健康威胁的流行病学和实验最新论文的仔细收集。除了总结光污染与肥胖、精神障碍、癌症等的新关联外,我们通过昼夜节律干扰强调光污染的毒理学机制,因为光污染直接干扰自然光暗循环,并破坏生物体的昼夜节律光夹带。并通过回顾人造光引起的生物钟基因的改变和褪黑激素稳态的紊乱,在积累研究的基础上挖掘光污染的深远影响,从而为未来的研究和指导相关法规和标准提供视角。
介绍
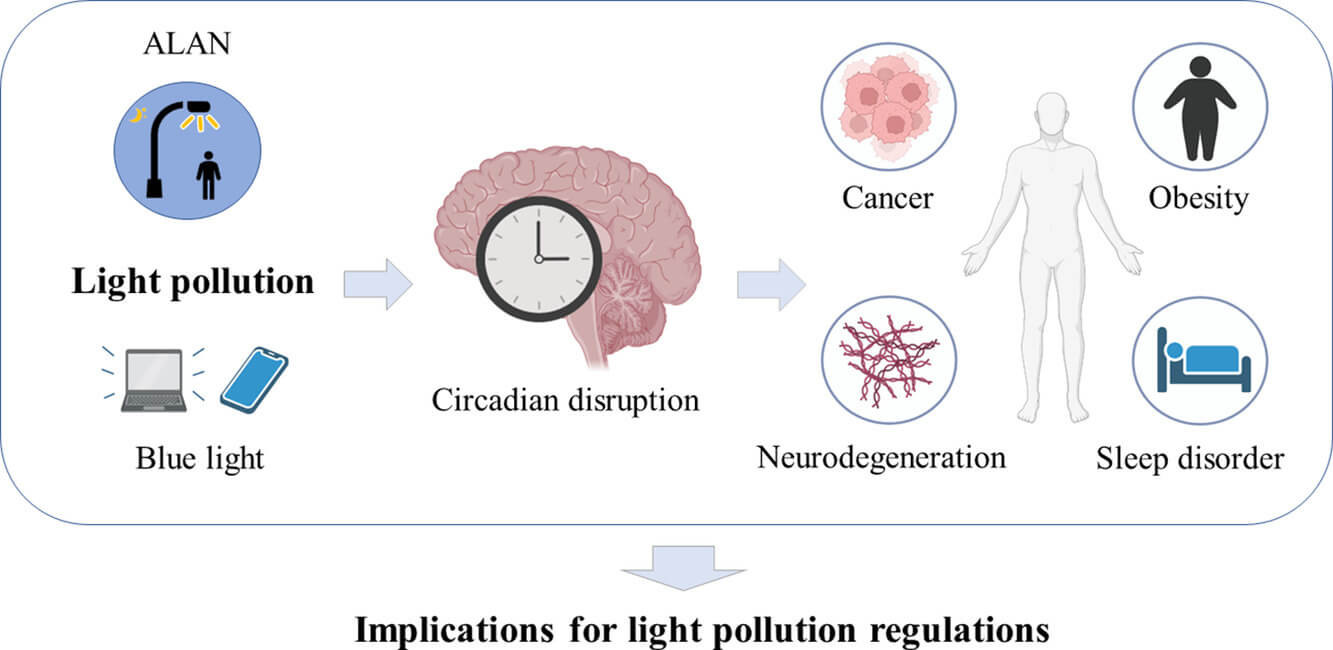
光污染是随着城市化和工业化的深入而出现的一个新的环境问题。在过去的几十年里,光污染对人类健康的威胁急剧增加(Davies 和 Smyth,2018 年),据估计,今天世界上超过 80% 的人口受到不同形式的光污染的影响(Falchi等人,2016 年)。根据最近的流行病学研究,不仅是辐射强度,光污染的光谱和时间也是影响其与健康结果关联的潜在因素,这促使夜间人造光 (ALAN) 和蓝光成为最受关注的光案例污染(Fonken 和 Nelson,2016 年;Helbich 等人,2020 年;马吉奥等人,2019 年;沃克等人,2020a)。
现在,光污染对健康的潜在影响已经从睡眠障碍扩展到许多高度关注的疾病,例如肥胖症(Abay 和 Amare,2018 年;Esaki 等人,2021 年)、精神障碍(Kim 等人,2018 年;Namgyal 等人, 2020 年)和癌症(Clarke 等人,2021 年;Johns 等人,2018 年;Ritonja 等人,2020 年)。例如,一些研究发现室外/室内 ALAN 与西班牙和美国乳腺癌的潜在关联(Garcia-Saenz 等人,2018 年;Xiao 等人,2020b )。光污染与神经退化之间的关系,以及在夜间昏暗光线下 (dLAN) 的阿尔茨海默氏症早期症状也有报道(Kim 等人,2018 年)。
另一方面,研究之间的差异永远无法避免。上述关联在某些情况下受到质疑(Johns et al., 2018; Ritonja et al., 2020)。即使对于那些被广泛接受的健康结果,即睡眠,实验过程也确实受到各种参数的影响,包括时间/持续时间、光波长和动物模型的选择(Batra 等人,2020 年;Masís-Vargas 等人, 2020)。因此,从这些混杂因素中区分关键因素对于确定光污染的实际和直接后果至关重要。考虑到光污染的毒理机制,昼夜节律是迄今为止最重要的目标,它与多种健康结果相关,并且在多种调节因素的协同作用下,尤其是褪黑激素稳态。然而,关于光污染如何影响昼夜节律光夹带、分子钟模式和褪黑激素稳态的详细过程,存在巨大的知识缺口。
本综述旨在关注近五年光污染对健康影响的研究进展。在对光污染进行了基本介绍之后,我们总结了揭示光污染与高度关注的健康影响(如癌症、肥胖和精神障碍)之间的联系以及相关毒理学机制的最新进展。与往常一样,在此类健康结果的因果链中强调了昼夜节律紊乱的重要作用。还讨论了各国在调控光污染方面的努力。本次审查中的光污染范围仅限于 ALAN 和蓝光,因为其他种类尚未得到充分记录。
1 . 光污染:形式、光谱和强度
尽管人造光为现代社会带来了许多好处,但当照明变得不必要、低效和烦人时,往往会产生污染 ( Chepesiuk, 2009 )。根据国际黑暗天空协会 (2022) ,光污染被定义为“不恰当或过度使用人造光,可能对人类、野生动物和我们的气候造成严重的环境后果”。晴朗条件下满月天空的照度自然约为 0.1-0.3 勒克斯( Gaston 等人,2013 年),然而,即使是停车场和住宅小巷的昏暗灯光也可能分别为 10 lux(勒克斯)和 5 lux( Gaston等人,2013 年)等,2013)。在城市地区,这种低水平的夜间照明无处不在,在某些地方甚至可以高达 150 lux,这远远超出需要(Kyba 等人,2014 年)。此外,研究人员估计每年光污染的传播率为 2.2%,这表明污染在不久的将来会迅速扩大(Kyba 等人,2017 年)。
光污染可以多种形式发生。室外光污染的主要成分包括眩光、天光、光侵入和杂波(表 1)。例如,天辉因其对天体观测的干扰而被天文学家广泛关注。直射或反射向上的人造光散射在低层大气中,在天空中形成低强度(0.15 lux)的漫射背景光,从而形成天辉(Gaston et al., 2013)。由于光的散射,天光的影响范围远大于光源的面积。因此推测,室外光污染对人类健康和生态系统的负面影响可能比预期的更为广泛。

光污染在室内也很普遍,直接增加了照明不当对人体健康的健康风险。除了来自外界的光线侵入,人们越来越多的数字设备会发出不同类型的光。发出蓝光的智能手机和笔记本电脑等设备在家中很常见,还有发出白光的电灯和顶灯。发光二极管 (LED) 尤其值得关注,因为在过去十年中,全球照明用 LED 的市场份额从 5% 增加到 60% 以上,预计到 2025 年将超过 80%(Gaffuri 等人,2021 年) )。同时,LED 提供在蓝光 (460-500 nm) 处达到峰值的窄光谱(Helbich 等人,2020 年)。相比之下,自然光是全光谱和动态的(图 1)。自然光的波长和强度随时间变化,为生物体提供适时的光照信息。因此,如何在不牺牲照明的视觉和生物需求的情况下,最大限度地模仿自然光的强度和光谱,成为设计人造光的挑战。

图 1 光污染的照度特征。IDA:国际黑暗天空协会
2 . 光污染的典型健康威胁
2.1 流行病学研究的最新证据
借助先进的基于卫星的遥感技术,可以建立全球队列,流行病学研究为研究人员提供了大量的因果信息。因此,有人提出光污染与一些常见的健康问题(如肥胖、癌症和精神障碍)之间存在新的联系,尽管睡眠障碍仍然是主要的负面影响。表2总结了近五年(2018-2022)光污染观测研究的最新进展。
表 2 讨论光污染与常见健康问题之间关系的观察性研究 (2018-2022)
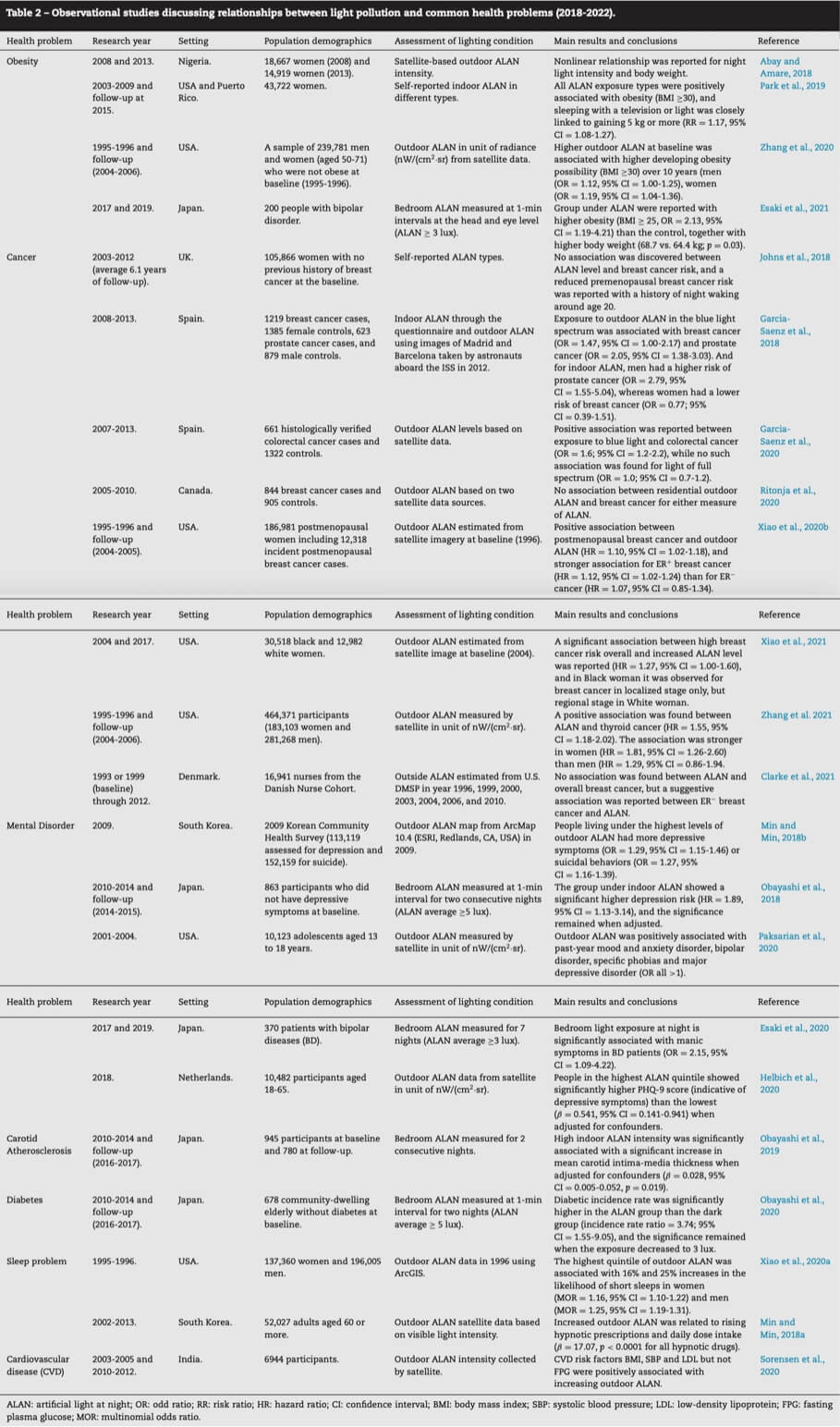
ALAN:夜间人造光;OR:奇比;RR:风险比;HR:风险比;CI:置信区间;BMI:体重指数;SBP:收缩压;LDL: 低密度脂蛋白; FPG:空腹血糖;MOR:多项优势比。
人类肥胖被证实与室内和室外 ALAN 呈正相关(Abay 和 Amare,2018 年;Esaki 等人,2021 年;Park 等人,2019 年;Zhang 等人,2020 年,尽管这种关联在女性多于男性。据Zhang 等人报道,(2020),男性和女性在室外 ALAN 下发生肥胖的比值比 (OR) 均高于 1,表明正相关,而女性的 OR 更高 (OR = 1.19,95% 置信区间 (CI) = 1.04-1.36) 高于男性 (OR = 1.12, 95% CI = 1.00-1.25)。此外,夜间光照强度之间的正相关关系并且女性的体重是非线性的,因为只有高阶段的光强度与肥胖和超重显着相关(Abay 和 Amare,2018 年)。
乳腺癌是迄今为止研究最多的与光污染有关的癌症类型,但由于研究之间存在差异,它们之间的因果关系仍然有些不确定。加西亚 - 萨恩斯等人,2018报告称,根据 1,000 多名西班牙女性的病例,室外 ALAN 暴露于蓝光光谱与乳腺癌的奇数比为 1.47。肖等,(2021)发现在不同种族的女性中,总体乳腺癌风险与 ALAN 水平升高之间存在显着的阶段特异性关联。对于黑人女性,统计显着性仅存在于局部癌症分期(风险比 (HR) = 1.45,95% CI = 0.99-2.14),但在白人女性中是局部癌症分期(HR = 2.42,95% CI = 1.07-5.45)。同一个团队还关注绝经后女性参与者的风险,发现雌激素受体阳性乳腺癌与雌激素受体阴性亚型的关联更强(Xiao 等人,2020b)。然而,在其他一些研究中,未发现乳腺癌与室外/室内 ALAN 之间存在任何关系(Clarke 等人,2021 年;Johns 等人,2018 年;Ritonja 等人,2020 年)。例如,[约翰斯等人,(2018)使用自我报告的 ALAN 类型来检查参与者的夜间光强度,发现没有关联,而 ALAN 的光谱在他们的研究中是未知的。忽略这一特征可能是本研究的主要局限性,因为大量数据证明蓝光会极大地影响褪黑激素系统和昼夜节律[Lockley 等人,2003 年];[Chang 等人,2015 年]。除了乳腺癌,[Garcia-Saenz 等人,(2018)]报道了蓝色户外 ALAN 与男性前列腺癌之间的强烈关联,奇数比为 2.05,95% CI = 1.38-3.03。该团队还报告了蓝光 ALAN 与结直肠癌之间的正相关关系,而在较长波长下未观察到这种关系[Garcia-Saenz 等人,2020 年]。此外,美国一项大型队列研究发现 ALAN 与甲状腺癌发病率呈正相关,女性的风险比 (HR = 1.91, 95% CI =1.26-2.6) 高于男性 (HR = 1.29, 95% CI =1.26-2.6) 95% CI = 0.86-1.94) (Zhang et al., 2021]。
与包括抑郁症在内的精神障碍的关联是ALAN近期健康问题的另一个热点,这在韩国( [Min and Min, 2018b] )、日本( Obayashi [et al., 2018])、荷兰( [Helbich 等人,2020 年])。[Paksarian 等人。(2020)]调查了户外 ALAN 与美国青少年各种类型精神障碍的可能关联,并获得双相情感障碍(OR = 1.19,95% CI = 1.05-1.35)、特定恐惧症( OR = 1.18,95% CI = 1.11-1.26)和重度抑郁症或心境恶劣(OR = 1.07,95% CI = 1.00-1.15)([Paksarian 等,2020]). 在一项横断面研究中,室内 ALAN 与双相情感障碍患者的躁狂症状显着相关(OR = 2.15,95% CI = 1.09-4.22)([Esaki 等人,2020 年])。
还有基于日本 HEIJO-KYO 队列的纵向研究调查卧室 ALAN 与新发糖尿病 ( [Obayashi et al., 2020]) 和颈动脉粥样硬化 [Obayashi et al., 2019 ]之间的关联。结果表明,ALAN 与这两种疾病都有因果关系,即使室内 ALAN 降至 3 lux,糖尿病仍与糖尿病密切相关。[索伦森等人(2020)]研究了室外光强度对心血管疾病危险因素的影响,发现体重指数 (BMI)、收缩压 (SBP) 和低密度脂蛋白(LDL)而非 FPG(空腹血糖)与室外 ALAN 增加呈正相关。同时,两项研究分析了与睡眠问题的关联,分别证明了增加室外 ALAN 对缩短睡眠时间和增加催眠处方的主要贡献([Min 和 Min,2018a];[Xiao 等人,2020a])。
2.2 基于实验室的研究
2.2.1 癌症
根据[国立环境健康科学研究所癌症危害评估技术报告(2021)],ALAN可作为环境致癌因子促进肿瘤的增殖和进展。先前的研究确定了关键的致癌物特征,例如氧化应激增加、免疫系统改变以及 ALAN 下细胞增殖失调([Navara 和 Nelson,2007 年])。近五年来,相关研究在研究 ALAN致癌性中涉及的主要信号通路和表观遗传修饰,以及波长依赖性效应方面取得了进展。[项等,(2019)]在暴露于 dLAN 后,在具有 MCF-7 乳腺肿瘤异种移植物的大鼠中证明了肿瘤的快速生长和对紫杉醇的内在抗性。通过 dLAN 破坏昼夜节律褪黑激素系统,IL-6/STAT3/DNMT1 信号通路被激活,从而抑制肿瘤抑制因子 ARH1。祖比达等人,(2018)研究了不同波长的 ALAN 如何影响接种了乳腺癌细胞的雌性 BALB/c 小鼠的肿瘤生长。结果表明,短波长的 ALAN 可促进肿瘤生长,增加全局 DNA甲基化,并促进肺转移形成,而长波长的作用相对减弱。该团队还观察到 ALAN 下 DNA 甲基转移酶的酶活性较低但具有组织特异性([Agbaria 等人,2019 年])。然而,蓝光与癌症之间的因果关系仍存在争议。白天接触蓝光有助于维持健康的昼夜节律并增强感光性 T 淋巴细胞的活力,从而促进免疫功能([Merrill 和 Frutos,2020 年];Phan 等人, 2016 年)。因此,时间是否影响蓝光的致癌性有待进一步探索。
2.2.2 代谢紊乱
直到最近,代谢紊乱与光污染之间的关联才引起人们的广泛关注。慢性和急性光污染暴露都会影响糖皮质激素和脂质等许多内源性分子的代谢(Fleury 等人,2020 年;Nelson 和 Chbeir,2018 年)。在 8 周的长期 ALAN 暴露下,在 2 型糖尿病小鼠模型中发现体重增加和代谢异常加剧,但胰岛素抵抗的破坏在回到黑夜后被逆转(Russart 等人,2019 年) ). 另一项研究针对光污染的影响是否与色温有关(Alaasam 等人,2018 年)). 结果发现,斑胸草雀 ( Taeniopygia guttata ) 在 5000 K(与 3000 K 相比)的较高色温下进行为期三周的LED夜光处理导致预处理后皮质酮水平大幅增加,以及夜间活动增加,并且没有观察到性别依赖性差异。
对于短期 ALAN 暴露,斑胸草雀的脂肪组织表现出明显的促炎状态,表明免疫和内分泌模式对 ALAN 具有敏感性(Mishra 等,2019)。Masís-Vargas 等人。(2020)比较了雄性 Wistar 大鼠在不同颜色的短期 ALAN 暴露和黑暗阶段不同时间点的代谢特征。即使在低强度下,肝脏中的能量消耗和代谢相关基因表达也会在 ALAN 下受到严重干扰。此外,所有观察到的影响都取决于一天中的时间和光的波长,这表明可能分别涉及昼夜节律系统和光感知。该团队还基于昼夜活动的苏丹草鼠 (Arvicanthis ansorgei )提供了夜间蓝光对葡萄糖代谢有害影响的进一步证据( Masís-Vargas 等人,2019 年)). 有趣的是,在这项研究中,蓝光对葡萄糖代谢具有严重的性别依赖性影响。糖摄入量增加和胰岛素分泌减少在男性中尤为显着,同时葡萄糖耐受不良程度更高。此外,尽管动物研究已广泛证实,但在人类中并未发现对葡萄糖稳态。在室内 ALAN 暴露(<5 勒克斯)两晚后,在不改变葡萄糖、胰岛素和 c 肽的代谢的情况下,发现睡眠结构和质量受到干扰。因此,葡萄糖代谢的改变是蓝光特有的,还是在人造光下广泛观察到的,仍有待研究。
2.2.3 精神和神经障碍
最近的研究表明,即使急性接触 ALAN 也有可能导致神经系统变化和精神障碍表型。当小鼠连续 3 晚暴露于 5 lux 的 ALAN 时,可能会出现抑郁样行为,同时海马体中促炎细胞因子和神经营养蛋白的含量也会发生变化(Walker et al., 2020b)。此外,在暴露的雄性小鼠中报告了一种潜在的补偿机制,因为与雄性对照相比,时钟基因clock和cry1的表达在 ZT2 显着增加。然而,其他研究表明在慢性 ALAN 暴露下没有或可逆的抑郁样表型(Bedrosian 等人,2013b;Castro 等人,2005 年)), 提示研究需要进一步探讨 ALAN 暴露下精神障碍的潜在代偿机制。
在人造光的治疗下,与神经退行性变相关的变化是一个高度关注的健康问题,非常明显。多巴胺能系统的异常被认为是帕金森病最显着的生物标志物之一。罗密欧等。(2013)报道了在连续暴露于强光(荧光灯)20 或 90 天后,黑质中神经黑色素的形成增加和多巴胺 (DA) 神经元减少。奥曼等人。(2016)检查酪氨酸夏季和冬季人类死后脑组织中的羟化酶和 DA 转运蛋白免疫反应性。结果发现,夏季酪氨酸羟化酶阳性神经元的密度明显高于冬季(约 6 倍),但尚不清楚这种差异是由不同的光周期引起的还是由于室内人造光的更多使用冬天。通过将 tau 病变果蝇暴露于 dLAN (10 勒克斯) 3 天,在这些阿尔茨海默氏病果蝇中观察到磷酸化 Tau 蛋白的形成增加,以及节律行为紊乱和睡眠-觉醒周期改变,共同表明昼夜节律紊乱和神经变性的促进(Kim 等人,2018 年)。同样, Namgyal 等人。(2020)评估了 dLAN (5 勒克斯) 对瑞士白化小鼠三周的影响。认知和非认知行为受损,以及 BDNF、CREB、SIRT1 mRNA 和神经变性相关 miRNA21a-5p 和 miRNA34a-5p 的下调均有报道。除了 dLAN,在日光下暴露于蓝光还会导致视网膜损伤、脑神经退化和果蝇运动受损。液泡面积的增加表明大脑中的神经元死亡,最终导致果蝇过早衰老(Nash 等人,2019 年)。
2.2.4 睡眠障碍
睡眠障碍是光污染引起的节律性健康问题的代表,之前越来越多的证据已经证明不适当的光照条件对睡眠/觉醒行为和睡眠持续时间的不利影响(Aulsebrook 等,2018)。最近的实验室研究进一步调查了对详细睡眠结构和睡眠参数的影响。Panagiotou 等人进行的研究。(2020)表明,即使在短时间内暴露于一天的 dLAN 中,睡眠也已经受到影响,并且随着 dLAN 暴露时间的延长,情况会变得更糟。通过检查睡眠恶化网络,发现脑电图(EEG) 功率密度谱值在暴露于三个月 dLAN 的小鼠中减弱。同时,有人提出,慢性(三个月)dLAN 暴露导致年轻人的睡眠结构向先前确定的衰老表型发生更显着的变化,而对于老年人,与年龄相关的睡眠交替增强(Panagiotou 和 Deboer,2020 年)。还有一项研究表明,dLAN 暴露小鼠的慢波睡眠 (SWS) 或快速眼动 (REM) 睡眠等睡眠参数没有统计学差异(Borniger 等人,2013 年)。对结果差异的一个可能解释是,潜在的补偿机制可能使生物体部分可调并能够应对(Mentink 等人,2020 年)). 这种补偿策略的性质被认为是睡眠的稳态调节。体内平衡和昼夜节律过程共同决定了睡眠表现的大多数方面(Deboer,2018 年)。然而,补偿并不是万能的。一旦超过一定的阈值,补偿机制就无法继续运作。这种现象在三个月延长的 dLAN 暴露下很明显(Panagiotou 和 Deboer,2020)。
然而,值得注意的是,大多数现有研究都是基于夜间模型(小鼠或大鼠),需要非常小心地将他们的实验结果外推到人类健康,因为夜间和昼夜物种具有不同的光反应睡眠模式. 近年来,越来越多的研究人员开始选择各种昼夜物种,如昼夜鸟类或脊椎动物进行进一步研究。例如,Batra 等人。(2020)将昼夜活动的雌性斑马雀暴露在 5 lux dLAN 下三周,观察到夜间睡眠不足和睡眠片段化。结果还显示参与昼夜节律和睡眠调节的基因的下丘脑表达模式改变,表明 dLAN 对 Ca 2+的影响-依赖性睡眠诱导通路。
3 . 毒理学机制:昼夜节律紊乱
生物体的昼夜节律由内部生物钟组成,这些生物钟与外部环境线索(例如光)同步以保持适当的计时(Masri 和 Sassone-Corsi,2018 年)。健康的昼夜节律系统为绝大多数生理和行为过程提供节律调节,例如睡眠/觉醒行为、日常新陈代谢、心血管功能、认知和记忆(Patke 等人,2020 年;Reinke 和 Asher,2019 年)。而在过度的环境光压下,例如 ALAN 会极大地扰乱自然光周期,昼夜节律系统会受到挑战,并且会发生上述生理失调和疾病 ( Chepesiuk, 2009 ;麦克纳马拉等人,2011 年)。
3.1 昼夜节律光夹带
由于光是生物体昼夜节律的主要“时间”,因此光污染会直接干扰生物钟的自然光夹带。进化上保守的昼夜节律主要由三部分组成:输入通路、中央时钟和输出通路。对于哺乳动物,眼睛后部的视网膜使用各种光感受器来接收光信息。然后视网膜神经节细胞 (RGC),即视网膜的输出神经元,向大脑中的中央时钟视交叉上核 (SCN) 发出信号 ( Wassle, 2004 )。外围振荡器通过体液和/或神经信号进一步接收来自中央起搏器 SCN 的时间线索,然后调节局部生理、心理和行为。
深入调查报告说,一小部分表达感光色素黑视蛋白的 RGC 被指定用于昼夜节律系统的光检测(Hattar 等人,2002 年;Hattar 等人,2003 年)。它们被称为固有光敏 RGC (ipRGC)。在整个光谱中,ipRGC 最容易受到蓝光的影响,在这种情况下,昼夜节律光夹带也呈现峰值敏感性(Hatori 和 Panda,2010)。这潜在地暗示了发蓝光 LED 对 ipRGC 的健康风险(Hatori 等人,2017 年)). ipRGC 对十几个大脑区域有广泛的投射,包括对昼夜节律 (SCN)、情绪(缰核周围)、睡眠和清醒(下丘脑,腹外侧视前区)具有深远影响的区域(Mure,2021 年;Schmidt 等人) , 2011 ). 特别是,从 ipRGCs 到其主要目标 SCN 的神经支配对于协调生物钟和驱动昼夜节律一致性至关重要。小鼠 ipRGC 的基因消融几乎完全破坏了 SCN 中的昼夜节律光夹带,而视觉形成没有受到影响(Guler 等人,2008 年)。
中央起搏器 SCN 有大约 10,000-20,000 个神经元调节动物的昼夜节律行为。在 SCN 中,主要有两个子区域,即“核心”和“壳”,具有不同的神经化学特性(Liu 等,2007;Swaab 等,1985;Videnovic 等,2014 )。视网膜受体核心包含分泌血管活性肠多肽(VIP) 和胃泌素释放肽 (GRP) 的神经元,而分泌精氨酸加压素(AVP) 和促动力素 2 (PK2) 的神经元大多位于壳中( Colwell,2011 年;Golombek 和 Rosenstein, 2010 年)。SCN 中的 VIP 神经元对于哺乳动物产生昼夜节律运动是必不可少的(托德等人,2020 年)。它们对于通过自发钙信号传导响应环境光提示的日常节律的正常重置也是必不可少的(Jones 等人,2018 年)。当阻断这些神经元的活动时,光诱导的运动相移就会受到影响。SCN 中的神经元除了与环境同步外,还需要彼此保持同步。它们通过突触传递进行通信并形成相互连接的电路。在 ipRGCs 光夹带后,神经递质例如 γ-氨基丁酸 (GABA) 和 VIP 从突触前核心神经元释放并与它们在突触后壳层神经元中的受体结合,并导致随后的事件,如 CREB(cAMP 反应元件结合蛋白)的磷酸化和诱导PER 和 CRY 转录,从而建立一个新的昼夜节律阶段 ( Liu et al., 2007 ; Welsh et al., 2010 )。这也意味着 SCN 神经元的紧密耦合,使得 SCN 在面对环境挑战时更加稳健。
外周时钟涉及许多组织,如肝、肺、肾、心脏和脂肪组织,大量证据表明昼夜节律在其正常生理功能中的重要作用。例如,肝脏和胰腺时钟控制葡萄糖的稳态,肌肉而非大脑中的生物钟对于小鼠的正常活动和体重至关重要(Patke 等人,2020 年)). 这些器官直接从 SCN 接收信号,或主要通过神经内分泌途径接收 SCN 介导的信息,从而实现与不断变化的环境的整体同步。同时,激素的节律被广泛认为是内源性节律的标志。例如,SCN 直接控制松果体中褪黑激素的分泌,然后这种光敏激素从大脑循环到身体的各个部位,调节睡眠/觉醒周期和节律活动 ( Gunata et al., 2020 )。
3.2 分子钟的图案化
大约 10% 的整个哺乳动物基因组由时钟基因控制,因此组织良好的时钟基因分子网络至关重要(Masri 和 Sassone-Corsi,2018)。哺乳动物的分子生物钟由两个转录翻译反馈回路组成,一组时钟基因在 24 小时周期左右振荡。在核心环中,正向元件 CLOCK 和 BMAL1 形成异二聚体复合物,并与 PER 和 CRY 增强子/启动子区域的 E-box 序列结合(Patke 等人,2020 年)). 然后 PER 和 CRY 与时钟控制基因一起在白天增加了它们的表达。在夜间,PER 和 CRY 的这种积累反过来抑制 CLOCK-BMAL1 的转录,从而阻碍它们自身的表达并诱导昼夜节律的重启。另一个辅助循环主要涉及两个核受体,REV-ERB 和 RORα。它们通过 REV 反应元件 (RRE) 抑制或激活 BMAL1 的转录(Preitner 等人,2002 年;Sato 等人,2004 年)。次级回路起到稳定和增强整个时钟振荡过程的作用(Nawrot et al., 2018)。
光可以直接引起分子钟基因的交替,结果随曝光时间点的不同而不同。夜间光照会引起分子钟的相移,而白天光照处理不会引起显着变化 ( Colwell, 2011 )。分子钟的表观遗传修饰被认为是一种重要的作用机制。它们主要包括组蛋白修饰和 DNA甲基化,其中基因表达的可遗传改变发生在不改变 DNA 序列的情况下(Sahar 和 Sassone-Corsi,2013 年)。例如,SCN 时钟细胞组蛋白 H3 尾部的 Ser10 在夜间光脉冲下被磷酸化 ( Crosio et al., 2000 )。c-fos的表达式和 PER1 也被诱导。此外,全基因组甲基化分析显示,长期倒班工人中超过 5000 个 CpG 位点的表观遗传模式发生了改变,尤其是低水平的 CLOCK 启动子甲基化和高水平的 CRY2 启动子甲基化(Stevens 和 Zhu,2015),但 ALAN 是否可能引发类似的甲基化交替在很大程度上是未知的。
在分子水平上,夜间昏暗光照可以改变 SCN 和外周组织中时钟基因的表达。据估计,睡眠环境中典型的光照水平约为 5 勒克斯,比自然水平(即月光下)亮五倍(Gaston 等人,2012 年)。当小鼠暴露在光照(150 勒克斯)/昏暗光照(5 勒克斯)周期下一个月时,下丘脑分子钟的基因和蛋白质水平都受到影响,PER1 和 PER2 表达的节律幅度降低(Fonken 等等人,2013 年)。在 12 小时光照(150-200 勒克斯):12 小时昏暗白光(5 勒克斯 dLAN)时间表中,SCN 中的 BMAL1 表达显示 Wistar 大鼠的振荡减弱(Stenvers 等人,2016 年)). 在昆虫和仓鼠中报道了 dLAN 下节律振幅的类似衰减效应(Bedrosian 等人,2013a;Honnen 等人,2019)。对主时钟 SCN 的不利影响会进一步影响外围时钟,即使在响应提前或延迟的环境光照周期时,SCN 可以比外围组织中的节律更快地调整(山崎等人,2000 年)。例如,dLAN 还会抑制肝脏中 REV-ERB mRNA 表达的幅度(Fonken 等人,2013 年)。
时钟基因表达的改变也被认为是许多与光污染相关的疾病的主要致病因素,因此它可能有助于解释光污染对健康的威胁。以神经变性为例,在中国患者中发现 BMAL1 和 PER1 基因与帕金森病呈显着正相关(Gu et al., 2015)。维德诺维奇等人。(2016)检查了 PD 患者全血中 PER1、2、3 和 BMAL1 的表达与疾病严重程度、睡眠质量和 PD 白天嗜睡之间的关系。结果显示,四种时钟基因的相位在不同白天嗜睡程度和睡眠质量的患者中存在明显差异。还发现两种与神经变性相关的 microRNA,miRNA21a-5p 和 miRNA34a-5p,在暴露于 5 勒克斯室内 ALAN 的三周后下调(Namgyal 等人,2020 年)。
3.3 褪黑激素稳态
褪黑激素系统一直被认为是 ALAN 的主要生理目标,尤其是蓝光。最近的研究在监测其在新近与光污染相关的疾病中的作用方面取得了进展。许多昼夜节律过程都需要褪黑激素,而褪黑激素的分泌本身也遵循一定的节律( Xie et al., 2017 )。更具体地说,在人类和昼夜动物中,褪黑激素在夜间产生以增加睡眠倾向,其最大血浆水平在凌晨 3-4 点达到峰值(Lavie,1997 年;Zisapel,2018 年)). 褪黑激素的不规则水平和昼夜节律时间将进一步扰乱其生理和神经功能。例如,褪黑激素具有抗淀粉样蛋白生成作用,可阻止大脑中 β-淀粉样蛋白原纤维的产生,对阿尔茨海默病具有重要的保护作用(Gunata 等人,2020 年;Shukla 等人,2017 年)。此外,通过在 PD 动物模型中补充褪黑激素,可以提高抗氧化酶的水平并抑制过度的氧化应激( Saravanan 等人,2007 年)). 因此,褪黑激素水平被认为是神经变性进展的生物标志物。褪黑激素还可以影响下丘脑-垂体-卵巢轴并进一步减少雌激素的产生,因此褪黑激素水平低和雌激素水平高在乳腺癌的发展过程中具有很好的特征(Jaynes 和 Switzer,2021)。它还可以在体外试验中改善细胞粘附并阻碍乳腺癌细胞的侵袭潜力( El-Sokkary 等,2019)。
大量研究表明,褪黑激素抑制对短波长光高度敏感。例如,健康人夜间暴露在 460 nm 单色光(蓝色)下 6.5 小时的昼夜节律相位比暴露在 555 nm 光(绿色)下多两倍,褪黑激素抑制率从 65% 到 96% 不等(Lockley 等人等人,2003 年)。睡前从电子阅读器发出的富含蓝色的电灯导致参与者晚间血浆褪黑激素水平降低 55.12% ± 20.12%,并且还报道了褪黑激素发作延迟超过 1.5 小时(Chang 等人,2015 年)). 此外,研究发现闪烁蓝光和非闪烁蓝光均能敏锐地抑制唾液中的褪黑激素,闪烁蓝光下褪黑激素的减少明显低于另一种(Kozaki et al., 2020)。
4 . 对光污染监管的启示
随着人们对光污染的各种健康后果的认识不断增加,公众开始关注,一些国家已经出台了控制光污染潜在影响的法律法规。2002 年初,捷克共和国成为第一个禁止过度户外照明的国家(Clarke,2002 年),并且所有户外灯具都需要屏蔽以防止光线超出水平面。在英国,清洁社区和环境法案于 2005 年进行了更新,以纳入人造光带来的滋扰(Taylor,2006 年)。法国关于预防、减少和限制光污染的法令对室外照明装置的设计和运行给出了详细的技术要求(巴伦丁,2019 年)。特别是,该法令通过要求光的相关色温 (CCT) 在所有情况下都应低于 3,000 K 来限制蓝光的发射。还明确了允许的照明水平,以防止过度照明。
除国家立法外,各级标准和地方性法规在限制光污染方面也发挥着重要作用。例如,中国从二十年前开始就越来越重视对光污染的监管。2022年4月1日起实施的国家标准《建筑环境通用规范》(GB 55016-2021)要求对住宅、医院、学校等周边区域的玻璃幕墙反射光影响进行分析。在上海,光污染防治2011年至2013年相继颁布的措施涵盖住宅、商业和建筑外部照明等方面。限制包括最大光照强度、垂直照度, 以及灯具的上行光输出比根据环境分区的划分进行分级调控(上海市质量技术监督局,2012)。
然而,目前在光污染监管的考虑中,对健康的不利影响只占很小的比例。综合观察时节能和降低背景干扰仍然是限制环境照明的主要目标(光磊等,2019))。例如,韩国首尔市政府于2010年7月颁布了光污染预防和管理条例。根据该条例,其目的是“通过防止不必要的照明行为,提高公民的生活质量,保护生态系统,节约能源”,“光环境管理区”更多地根据生产和生活的不同需求进行分类,而不是环境照明的潜在健康风险。《上海市光污染防治措施》在制定相关标准时,只对主观层面的光干扰心理和/或眼疲劳进行健康评价。因此,从健康角度出发,提供充足的光照阈值证据和建议,也是更加科学地进行光污染治理的主要任务之一。
5 . 结论和观点
本综述重点介绍了近五年(2018-2022)光污染对健康威胁的研究进展。研究人员将 ALAN 和蓝光的影响扩大到神经变性和癌症等更严重的疾病,并在因果关系中确定了重要的促成因素。在流行病学上,最近的研究在更准确地调整混杂因素方面取得了进展,并验证了光波长、强度和时间的重要性,尽管研究之间仍然存在不一致。动物研究区分了急性和慢性暴露的影响,相关的毒理学研究一直围绕着昼夜节律紊乱展开。人们发现,长期暴露于光污染往往会导致整体昼夜节律紊乱,而急性实验主要会对周围组织产生影响。光污染下的性别、波长和时间相关的变化也被新记录,但由于不同的实验设置和动物模型的选择,它们并不总是很明显。值得注意的是,我们强调褪黑激素系统的破坏是连接光污染流行病学(尤其是在蓝光下)与昼夜节律的毒理学途径的关键风险因素光感受器ipRGCs对褪黑激素系统的影响越来越受到关注。最后,我们总结了世界范围内光污染法规的历史和现状,并报告了在制定相关政策法规时考虑广泛的健康威胁的不足。未来,更多关于光污染的努力应该揭示以下问题的缺失信息:
(1)光污染与乳腺癌之间的关联已经得到流行病学和动物研究的证实,而对其他种类癌症的担忧还很不足。此外,性别差异在光污染导致的非生殖系统癌症中的潜在作用需要进一步研究。
(2)昼夜节律紊乱是在急性和慢性光污染暴露中观察到的主要健康结果。值得注意的是,大多数现有的动物研究都是基于鼠类模型,同时应仔细考虑,因为这些夜间活动动物的生物节律与人类有很大不同。因此,昼夜动物模型的应用有望为相关研究提供必要的补充。
(3)复合污染在现实环境中非常普遍,光通常与空气中的颗粒物和化学物质共存。这些污染因素在城市的下午和晚上高度重叠。到目前为止,只有新的研究记录了 ALAN 与 PM 2.5的短期综合影响。它们潜在的协同健康威胁仍有待揭示。
(4)中国等发展中国家在过去 20 年通过制定区域性法规和标准迎头赶上,但仍缺乏综合监管,尤其是在国家层面。应该做出更多努力来完善相关法律,包括根据对眼睛疲劳的深远健康结果制定照明限制。
本研究报告参考资料和上文中引用资料请参见原文,或下载PDF。